01 金属在酸溶液中的腐蚀
酸是一类能在水溶液中电离,形成H3O+离子化合物的总称。一般用H+代表H3O+。
氧化性酸与非氧化性酸对金属的腐蚀情况大不相同。
腐蚀过程中,非氧化性酸的特点是腐蚀的阴极过程基本上是氢去极化过程,增加溶液酸度相应地会增加阴极反应,并使金属腐蚀速度增加。 氧化性酸的特点是阴极过程主要是氧化剂的还原过程引起金属腐蚀(如硝酸根还原成亚硝酸根)。但氧化性酸浓度超过某一临界值时,使钝化型金属进入钝态,抑制了腐蚀。酸溶液腐蚀性一方面与酸的强弱,同时也与酸的阴离子的氧化能力有关。
工业无机酸有硫酸、硝酸、盐酸, 他们引起的设备腐蚀破坏和造成的经济损失相当严重。
02 金属在硫酸中的腐蚀
高浓度H2SO4是强氧化剂,能使具有钝化能力的金属进入钝态,低浓度的H2SO4则没有氧化能力,其腐蚀性很强。
硫酸的腐蚀性最主要取决于温度和浓度,氧化剂、流速等也能影响硫酸对各种材料的腐蚀性。输送H2SO4时随浓度增加,流速增大,钢管寿命降低,输送硫酸时,不宜采用高的流动速度。
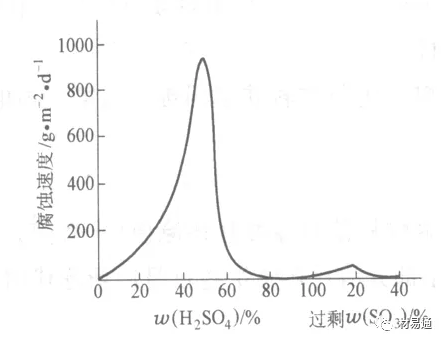
工业上耐硫酸的材料为价廉的碳钢,下图显示出铁的腐蚀速度与硫酸质量分数的关系。
铁的腐蚀速度与硫酸质量分数的关系
•硫酸质量分数低于50%时,碳钢的腐蚀速度随浓度增加腐蚀速度急剧增加;
•当质量分数超过50%时,随浓度增加,腐蚀急剧下降;
•当质量分数超过70%时,碳钢几乎不腐蚀。钢表面生成硫酸盐(FeSO4)保护膜。因此制造质量分数超过70%的浓硫酸的储罐与运输管线可用钢铁材料。
•当质量分数超过101%的中温发烟H2SO4时,应注意两个问题:①浓H2SO4是一种强吸水剂;②硫酸盐保护膜(FeSO4)易受破坏。
•当硫酸质量分数低于70%时,应采用铅制的设备,铅表面可以生成PbSO4的保护膜。在硫酸环境中,钢和铅具有互补性。
03 金属在盐酸中的腐蚀
HCl强酸, 除银、钛等少数金属外,大多数金属或合金在HCl中都不能生成难溶的金属盐膜。
HCl中Cl-有极强性,除钛等少数钝性优异的金属外,金属表面的钝化膜在盐酸中都因受到氯离子的破坏而发生点蚀。
工业纯铁与碳钢的腐蚀速度随盐酸的浓度成指数关系增加,钢不能用于盐酸介质中。
HCl中存在氧化剂时,铜、钼、镍基合金的腐蚀速度显著增加。当HCl浓度高时,阴极为氢去极化,但当盐酸浓度低时,氧去极化占优势,腐蚀速度增加。
对可电化学方法或化学方法钝化处理的金属材料,在HCl中它们的钝态区很窄或不存在。因此,耐HCl腐蚀的金属材料仅限于有极强钝化性能特殊金属及合金,如Ta、Zr及Ti-Mo合金等。
04 金属在硝酸中的腐蚀
HNO3氧化性的强酸,在其中能钝化的金属适用于HNO3,Ag、Ni、Pb、Cu不耐硝酸腐蚀
1)碳钢
碳钢在HNO3中的腐蚀行为见下图
•硝酸质量分数低于30%时,碳钢的腐蚀速度随酸浓度增加而增加,当质量分数约在30%附近时腐蚀速度达到最大值。
•质量分数超过30%,腐蚀速度迅速下降;
•质量分数达到50%时,腐蚀速度最小, 说明钢钝化了。•当质量分数超过80%时,碳钢的腐蚀速度再次急剧增加,钢出现过钝化溶解。
•铁或钢适用于HNO3浓度在30%~80%(质量分数)范围内。
2)不锈钢
对硝酸有良好的耐蚀性。不锈钢是硝酸系统中大量使用的耐蚀材料,如硝铵、硝酸生产中大部分设备都是用不锈钢制造的。浓度超过70%热硝酸中易发生过钝化腐蚀。
3)Al及其合金
对中等温度的发烟HNO3良好蚀性,[HNO3]<85%时,在室温,Al耐蚀性也不好。
4)高硅铸铁
Si质量分数>13%合金铸铁称为高硅耐酸铸铁。对各种无机酸包括盐酸均有良好的耐蚀性。
•高硅铸铁中Si的质量分数一般不超过15%,否则会生成介稳定的脆性η相(Fe5Si2)。
免责声明:本文文章内容转载来源:网络。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间处理!感谢您的支持与理解!